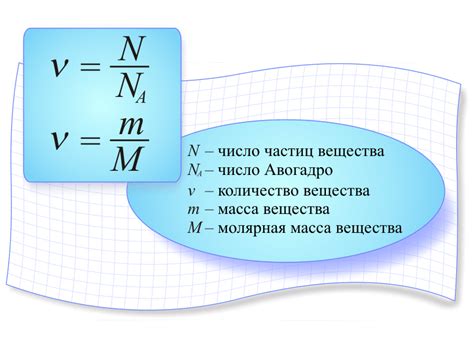
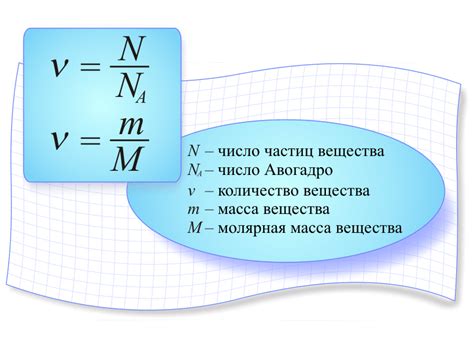
Когда мы говорим о химических соединениях, необходимо учитывать их содержание и состав. Определение объема вещества имеет огромное значение в понимании химических процессов и их применении в реальной жизни. Существует множество методов и иллюстраций, которые позволяют определить и количественно оценить содержащиеся в веществе компоненты.
Интересно, что каждый метод имеет свои преимущества и ограничения, и выбор того или иного подхода зависит от целей и требований исследования. Некоторые методы основаны на измерении изменения объема вещества при химической реакции, в то время как другие позволяют определить содержание вещества путем анализа физических свойств образовавшегося продукта.
Чтобы лучше понять, как проводится определение содержания вещества, рассмотрим несколько примеров из реальной химической практики. Одним из наиболее распространенных методов является титрование, которое основано на точном измерении объема раствора, необходимого для полного химического взаимодействия. Этот метод находит широкое применение в аналитической химии, позволяя определить содержание различных веществ, начиная от кислот и щелочей до оксидов и комплексных соединений.
Массовое определение количества вещества

В химии существует метод определения количества вещества по их массе, который основывается на измерении массы и применении соответствующих математических формул. Этот метод широко применяется в различных химических исследованиях и анализе образцов.
Процесс массового определения количества вещества включает в себя несколько этапов. Вначале, необходимо точно измерить массу образца вещества с помощью весов или баланса. Затем, проводится расчет количества вещества путем применения соответствующих математических формул, которые учитывают молярные массы и стехиометрические коэффициенты химических реакций. Полученные значения представляют собой количество вещества в молях.
Массовое определение количества вещества имеет широкий спектр применения в химии. Оно позволяет исследователям рассчитывать точные объемы вещества для проведения различных реакций, определять концентрацию растворов, контролировать качество и состав химических соединений, а также проводить анализы и эксперименты в области фармацевтики, пищевой промышленности и др.
| Пример | Масса (г) | Молярная масса (г/моль) | Количество вещества (моль) |
|---|---|---|---|
| Кислород (O2) | 32.00 | 32.00 | 1.00 |
| Аммиак (NH3) | 17.03 | 17.03 | 1.00 |
| Железо (Fe) | 55.85 | 55.85 | 1.00 |
Вышеприведенная таблица демонстрирует примеры массового определения количества вещества для разных химических элементов и соединений. Обратите внимание на то, как масса вещества прямо связана с его молярной массой. Таким образом, путем измерения массы образца и знания его молярной массы, можно точно определить количество вещества в молях.
Аналитическое определение количества вещества

В химии существует метод аналитического определения количества вещества, который позволяет установить точное количество реагирующих компонентов в химической реакции. Этот метод основан на использовании различных аналитических приборов и процедур, которые позволяют проводить качественный и количественный анализ.
Одним из наиболее распространенных методов аналитического определения количества вещества является титрование. Этот метод основан на принципе нейтрализации, когда известное количество раствора известной концентрации щелочи или кислоты реагирует с исследуемым раствором. С помощью специальных индикаторов или потенциометрии определяется точный момент, когда реакция достигла эквивалентности, что позволяет вычислить количественное содержание исследуемого вещества.
В другом методе аналитического определения объема вещества, известного как гравиметрия, используется взвешивание вещества или его осадка. Для этого образец вещества помещается на взвешивание до и после химической реакции. Разница веса позволяет определить количество вещества, так как известна реакция, в которой происходит изменение массы.
Определение количества вещества на основе законов газовой физики
Один из методов определения количества вещества в химии основан на газовых законах, которые описывают связь между объемом, давлением, температурой и количеством вещества в закрытой системе. Используя эти законы, можно вычислить количество вещества на основе измерений объема газа, давления и температуры, что позволяет установить количество вещества без прямого измерения его массы.
Закон Бойля, также известный как закон давления, устанавливает обратную пропорциональность между давлением и объемом газа при постоянной температуре. Этот закон позволяет определить изменение объема газа при изменении давления.
Закон Шарля, или закон линейной температуры, устанавливает, что объем газа прямо пропорционален его температуре при постоянном давлении. С помощью этого закона можно определить изменение объема газа при изменении температуры.
Закон Гей-Люссака или закон давления и температуры, устанавливает, что давление газа прямо пропорционально его температуре при постоянном объеме. Используя этот закон, можно определить изменение давления газа при изменении температуры.
Применение этих законов газовой физики в химии позволяет определять количество вещества на основе измерений объема, давления и температуры газов. Это особенно полезно при работе с газообразными веществами, когда масса вещества не может быть измерена непосредственно.
Применение методов измерения количества вещества в научных и промышленных областях
Существует множество методов, предназначенных для определения объема содержащегося вещества. Их применение в химии, науке и промышленности играет важную роль в анализе, контроле качества и производственных процессах.
Одним из примеров использования таких методов является гравиметрическое определение массы вещества путем измерения изменения массы системы до и после химической реакции. Этот метод широко применяется для определения содержания примесей в различных образцах, каталитической активности и точности измерений объема.
Другим примером является волюметрическое определение объема вещества посредством измерения его объемоемкости с помощью стандартных растворов. Такая методика находит применение в области анализа сортов вина, медицинской диагностики и в процессах стандартизации фармацевтических препаратов.
Дополнительно, кулометрия, метод титрования, электрохимический анализ, спектрофотометрия и газохроматография являются другими методами, которые широко используются для точного определения объема вещества в различных научных и промышленных областях.
Понимание и применение методов измерения объема вещества позволяет исследователям и специалистам получать точные результаты об анализируемых образцах и процессах, что является ключевым фактором в достижении успеха в различных индустриальных и научных областях.
Значимость точного определения величины объема речла в химических науках
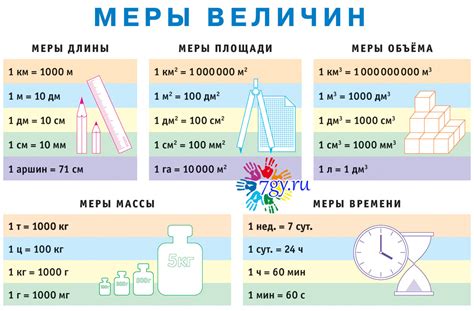
Определение объема является неотъемлемой частью процесса исследования в химических науках, а также в промышленной и медицинской сферах. Например, в химических лабораториях точное измерение объема вещества позволяет провести реакции и получить продукты с высокой степенью чистоты и эффективности. В медицине определение объема жидкости или лекарственных препаратов важно для правильной дозировки и обеспечения оптимального эффекта лечения. Точное определение объема также играет важную роль в производстве и контроле качества промышленных продуктов, например в производстве лаков, красок, растворов и т. д.
- Аккуратное проведение экспериментов и измерений.
- Точные математические расчеты и предсказания.
- Установление причинно-следственных связей и объяснений явлений.
- Оптимальная дозировка лекарств и химических веществ.
- Контроль и обеспечение качества продуктов.
- Более эффективный и экономичный процесс производства.
Вопрос-ответ

Как определяется объем вещества в химии?
Определение объема вещества в химии производится с помощью различных методов. Один из таких методов - гравиметрическое определение, которое основано на измерении массы вещества. Другой метод - волюметрическое определение, при котором измеряется объем газов, растворов или смесей. Еще один способ - определение объема с помощью газоанализаторов или спектрофотометров.
Какие примеры можно привести для определения объема вещества в химии?
Примеры методов определения объема вещества в химии могут быть разнообразны. Например, для определения объема газов можно использовать газоанализаторы, такие как доспехи, вольфрамовая головка, спектрофотометры и другие приборы. Для определения объема растворов можно применять методики титрования, при которых измеряется объем реагента, необходимого для полного прекращения реакции.
Каковы основные принципы определения объема вещества в химии?
Определение объема вещества в химии основывается на нескольких принципах. Волюметрическое определение основано на использовании известного объема раствора или газа для определения объема неизвестного вещества. Гравиметрическое определение основано на измерении массы вещества, что позволяет рассчитать его объем, зная плотность.Также применяются спектрофотометрия, газоанализаторы и другие приборы для определения объема вещества в химических реакциях.



