В мире химии, где каждый элемент имеет свою уникальную характеристику, определение атомного номера - одна из самых важных задач. Ведь именно на основе атомного номера мы можем точно идентифицировать и классифицировать элементы периодической системы.
Атомный номер - это числовая характеристика каждого химического элемента, которая помогает нам понять его внутреннюю структуру. Без знания атомного номера элемента было бы невозможно установить его массу, атомный радиус и другие ключевые параметры.
Но какими способами мы можем определить атомный номер элемента? Существует целый набор методов и техник, позволяющих установить этот важный показатель с высокой точностью и достоверностью. В данной статье мы рассмотрим несколько из них, чтобы предоставить вам подробное понимание процесса определения атомного номера элемента.
Определение номера атома через периодичную таблицу Дмитрия Ивановича Менделеева
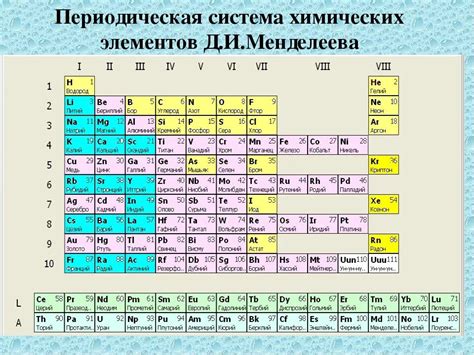
Каждый химический элемент в периодической системе имеет свое уникальное место, которое определяется его атомным номером. Атомный номер можно считать своеобразным "идентификатором" элемента, позволяющим однозначно его идентифицировать и различать от других элементов.
Атомный номер обычно обозначается латинской буквой Z и записывается над символом элемента в периодической таблице. Понимание атомного номера и его значения играет важнейшую роль в изучении и понимании химических свойств и реакций элементов.
Определение атомного номера на основе атомных масс и зарядов
Кроме использования прямых методов определения атомного номера элемента, существуют и другие способы, основанные на использовании атомных масс и зарядов элементов. Эти данные могут быть полезными при расчете атомного номера элемента.
Атомная масса - это масса атома данного элемента, выраженная в атомных единицах. Известная атомная масса элемента может быть использована для приближенного определения его атомного номера. Чем больше атомная масса элемента, тем выше его атомный номер в периодической таблице.
Заряд элемента является основным инструментом для определения его атомного номера. Заряд представляет собой электрическую величину, присущую атому элемента. Знак заряда (положительный или отрицательный) указывает на то, какие электроны были приняты или переданы атомом. Чем больше заряд элемента, тем выше его атомный номер в периодической таблице.
Сочетание атомных масс и зарядов элементов позволяет приближенно определить их атомные номера. Однако стоит учесть, что это метод не всегда точен и может содержать определенную погрешность.
В следующем разделе мы рассмотрим подробнее примеры использования атомных масс и зарядов элементов для определения атомного номера и обсудим их преимущества и ограничения.
Спектральный анализ: расшифровка светового языка атомов
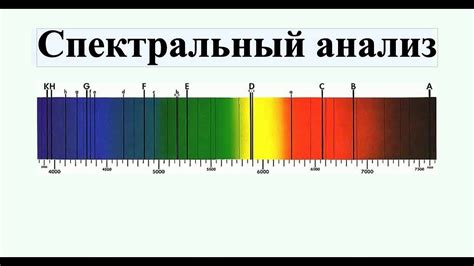
Способ определения атомного номера элемента, основанный на спектральном анализе, позволяет расшифровать уникальный световой язык, на котором общаются атомы изучаемого вещества. При освещении особым способом, атомы испускают и поглощают энергию в виде различных цветовых линий и полос, формируя спектр. Анализ этого спектра позволяет получить информацию о составе и структуре вещества, и, конечно же, определить его атомный номер.
В основе спектрального анализа лежит принцип того, что каждый элемент имеет свой уникальный набор спектральных линий, называемых также линиями поглощения или испускания. Каждая линия соответствует определенному энергетическому переходу между электронными орбиталями атома. Используя эти уникальные линии, их положение, интенсивность и спектральные характеристики, можно определить атомный номер элемента.
Спектральный анализ как метод определения атомного номера является универсальным и применим для большинства химических элементов. Он основан на изучении света, испускаемого или поглощаемого элементами, и позволяет определить состав и структуру вещества через его спектральный отпечаток. Этот метод является неотъемлемой частью современной материаловедческой, физической и химической науки и находит применение во множестве областей исследования и практических применений.
Спектральный анализ проводится с использованием специальных приборов, таких как спектрометры, фотометры, спектрофотометры и другие. Они позволяют измерять характеристики спектральных линий, такие как длина волны, интенсивность и ширина, что позволяет определить атомный номер элемента с высокой точностью. Благодаря спектральному анализу мы можем узнать, какие элементы присутствуют в образце, в каком количестве и в какой форме они находятся.
Спектральный анализ является мощным инструментом для определения атомного номера элемента, который позволяет углубить наше понимание мироздания и расширить возможности научных исследований и технологического развития.
Применение метода рентгеновской флуоресценции для определения заряда ядра химического элемента

Метод, основанный на рентгеновской флуоресценции, предлагает неинвазивный способ определения заряда ядра химического элемента, позволяющий получить информацию о его атомном номере без необходимости прямого физического взаимодействия с элементом.
Рентгеновская флуоресценция - это явление возникновения излучения рентгеновского диапазона длин волн при облучении вещества рентгеновскими лучами или гамма-квантами. Когда материал подвергается такому облучению, его атомы поглощают энергию и переходят в возбужденное состояние. При обратном переходе из возбужденного состояния обратно в основное, атомы излучают энергию в виде рентгеновского излучения, специфического для каждого химического элемента.
Используя рентгеновскую флуоресценцию, можно проанализировать спектр излучения, полученный от облученного материала, и определить наличие и концентрацию различных элементов в образце. Конкретно для заряда ядра химического элемента данный метод позволяет выявить характерные энергетические уровни рентгеновского излучения, связанные с различными атомными номерами элементов.
Таким образом, применение рентгеновской флуоресценции является надежным и точным способом определения атомного номера элемента, предоставляя информацию о заряде ядра без необходимости проведения сложных и дорогостоящих экспериментов. Этот метод широко применяется в различных областях, включая материаловедение, химию, археологию и медицину.
Электронная спиновая резонанс и ее важность в установлении ионного характера элементов

В этом разделе мы рассмотрим роль электронной спиновой резонансной спектроскопии в определении ионного характера элементов и ее значимость для определения атомного номера элемента.
Электронная спиновая резонанс (ЭСР) является мощным методом исследования структуры атомов и молекул. Она основана на использовании внешнего магнитного поля для наблюдения за вращением электронов вокруг своей оси, известной как спин. В результате взаимодействия магнитного поля с электронным спином происходит резонансное поглощение или испускание электромагнитной энергии.
Важное свойство ЭСР заключается в способности определения ионного характера элементов. Поскольку атомы элементов имеют разное число электронов во внешних оболочках, их спиновые параметры также отличаются. Таким образом, анализ спектра ЭСР позволяет установить, какие электроны являются недостаточно устойчивыми и могут быть легко перемещены для образования ионов.
| Электронная спиновая резонанс в определении ионного характера элементов: |
|---|
| Помогает установить, какие электроны в внешних оболочках наиболее подвержены ионизации. |
| Позволяет определить степень ионизации элемента и классифицировать его как катион или анион. |
| Используется для исследования изменений спинового состояния электронов в различных химических реакциях. |
| Предоставляет информацию о различных электронных конфигурациях атомов и молекул. |
Таким образом, электронная спиновая резонанс спектроскопия является важным инструментом для определения ионного характера элементов. Она позволяет установить, какие электроны являются наиболее подверженными ионизации и тем самым определить атомный номер элемента.
Изучение атомного состава методом масс-спектрометрии
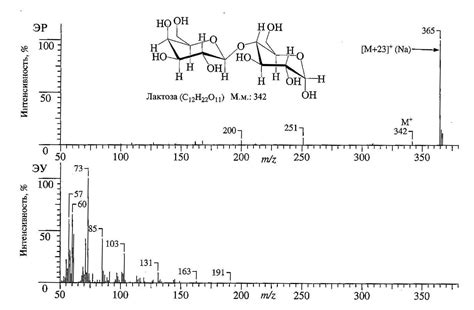
Масс-спектрометрия основывается на разделении ионов по их массе и заряду. В ходе анализа пробы вещества, она подвергается ионизации и далее массовые спектры полученных ионов регистрируются. По полученным спектрам можно определить как относительные, так и абсолютные атомные массы элементов, что позволяет определить их атомные номера.
Важным этапом в методе масс-спектрометрии является генерация ионов, которая может быть достигнута различными путями, включая ионизацию электронным пучком, химическую ионизацию или применение лазера. Ионы затем ускоряются с помощью электрического поля и поступают в масс-анализатор.
В масс-анализаторе ионы разделены на основе их отношения массы к заряду, и каждый ион достигает детекторов в масс-спектрометре, где они регистрируются. Полученные спектры позволяют определить массу ионов и тем самым установить атомный номер элемента.
Создание и использование изотопов в процессе определения номера атома

Синтез изотопов
Для создания изотопов используются различные методы, включая ядерные реакции, при которых происходит изменение числа протонов и нейтронов в атомном ядре. Синтез изотопов основан на использовании реакторов, акселераторов частиц и других специализированных установок.
Изотопы в процессе определения атомного номера
Изотопы могут быть использованы для определения атомного номера элемента путем их взаимодействия с другими веществами. В зависимости от химической реакции, изотоп с определенным номером атома может образовывать уникальные продукты, которые можно идентифицировать с помощью различных аналитических методов.
Одним из методов использования изотопов в определении атомного номера является изотопная маркировка. При этом изотоп с определенным номером атома помечается веществом или молекулой, которая затем используется в различных химических реакциях. Анализ полученных продуктов позволяет определить атомный номер элемента.
Применение изотопов в научных исследованиях
Использование изотопов в определении атомного номера не только помогает установить химическую природу элемента, но и находит применение в различных областях науки. Например, изотопы используются в медицине для диагностики и лечения различных заболеваний, в геологии для изучения возраста горных пород и в археологии для определения происхождения артефактов.
Таким образом, синтез и использование изотопов представляет собой мощный инструмент в определении атомного номера элемента и открывает новые перспективы для научных исследований в различных областях знания.
Рентгеноструктурный анализ: метод выявления ионного заряда в атоме
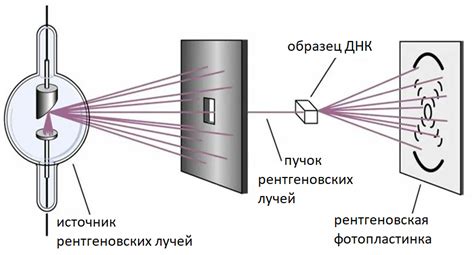
Существует один изощренный метод, обеспечивающий возможность определения количества протонов в атомном ядре элемента и, следовательно, его атомного номера. Данный метод основан на использовании рентгеноструктурного анализа, который позволяет точно определить пространственную структуру атомов в кристаллической решетке.
Оказывается, что под воздействием рентгеновских лучей, проходящих через кристалл, происходит рассеяние этих лучей на его атомах. С помощью специального аппарата, фиксирующего углы рассеяния и интенсивность отраженных лучей, можно получить информацию о взаимном расположении атомов в кристаллической решетке.
При рентгеноструктурном анализе используется так называемая рентгеновская дифракция, которая возникает при перебросе фазовой разности между двумя когерентными рентгеновскими лучами. Именно этот феномен позволяет определить относительное положение атомов в кристаллической решетке и, следовательно, композицию элементов, входящих в ее состав.
Таким образом, рентгеноструктурный анализ позволяет определить ионный заряд атомов в кристаллической решетке путем выявления расстояния между ними и углов рассеяния рентгеновских лучей. Зная ионный заряд атома и его относительное положение в кристаллической решетке, можно определить количество протонов в его ядре, что является основой для определения атомного номера элемента.
Рентгеноструктурный анализ является мощным методом, позволяющим проводить детальное исследование атомной структуры материала и выявлять информацию о его химическом составе. Тем самым, данный метод играет важную роль в изучении и определении атомного номера элемента.
Применение химических превращений и сбалансированных реакций для определения разновидности атомов веществ

В этом разделе рассматривается возможность использования различных химических процессов и уравнений для определения расположения и свойств атомов веществ. Знания об атомах позволяют установить их количество, вид и способность образовывать химические связи с другими элементами.
Химические реакции играют важную роль в определении атомного состава вещества. Они позволяют проследить изменения в атомной структуре и посредством балансировки уравнений получить необходимую информацию о различных атомах.
Для проведения эффективных химических реакций важно соблюдать баланс уравнений. Балансировка уравнений позволяет установить соотношения количества атомов разных элементов в химической реакции, что в свою очередь помогает определить атомный номер элемента.
Путем анализа и интерпретации химических реакций и балансировки соответствующих уравнений, можно получить информацию о разнообразии атомов вещества и определить их атомный номер. Таким образом, использование химических реакций и балансировки уравнений помогает приблизиться к пониманию и идентификации различных элементов и их химических свойств.
Изучение строения электронной оболочки и ее роли в определении порядкового номера атома
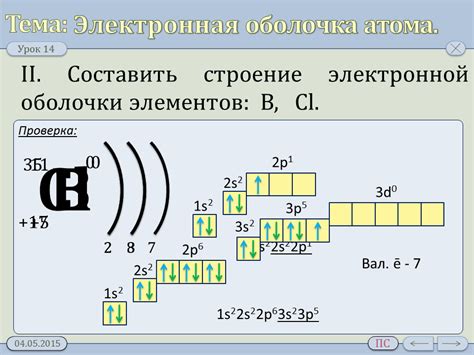
Электронная конфигурация представляет собой описание распределения электронов в энергетических уровнях атома. Каждый атом имеет определенное количество электронов, которые располагаются на разных энергетических уровнях и субуровнях. Наличие определенного количества электронов в электронной оболочке позволяет определить порядковый номер атома в периодической системе элементов.
Электронная конфигурация включает информацию о количестве электронов в каждом энергетическом уровне и субуровне атома, а также о наполнении оболочек и подоболочек. Она является основой для классификации элементов и определения их химических свойств.
| Энергетический уровень | Количество электронов |
|---|---|
| 1s | 2 |
| 2s | 2 |
| 2p | 6 |
Проанализировав электронную конфигурацию, можно определить количество электронов на каждом энергетическом уровне и вычислить суммарное количество электронов в атоме. С учетом порядка заполнения оболочек и субуровней, можно определить порядковый номер элемента, используя периодическую таблицу Менделеева.
Таким образом, изучение электронной конфигурации атома позволяет определить его порядковый номер и классифицировать элементы в периодической системе. Это важный шаг для понимания химических свойств и поведения элемента в химических реакциях.
Вопрос-ответ

Какие способы существуют для определения атомного номера элемента?
Для определения атомного номера элемента существуют несколько способов. Один из них - использование периодической таблицы химических элементов, где каждый элемент имеет свой уникальный атомный номер. Другой способ - использование рентгеновской кристаллографии, которая позволяет определить расстояние между атомами в кристаллической решетке вещества и на основе этих данных определить атомный номер элемента. Также можно использовать методы спектроскопии, включая эмиссионную спектроскопию и атомно-абсорбционную спектроскопию, которые позволяют определить атомный номер элемента на основе его спектральных характеристик.
Как можно определить атомный номер элемента с помощью периодической таблицы?
Определение атомного номера элемента с помощью периодической таблицы очень просто. В периодической таблице каждый химический элемент имеет свой уникальный атомный номер. Достаточно найти элемент, по которому нужно определить атомный номер, и посмотреть на число, указанное над его символом. Это число и будет атомным номером элемента. Например, для определения атомного номера элемента кислорода нужно найти его символ "O" в периодической таблице и обратиться к числу 8, которое указано над символом "O".
Как работает метод рентгеновской кристаллографии для определения атомного номера элемента?
Метод рентгеновской кристаллографии позволяет определить атомный номер элемента на основе измерения расстояния между атомами в кристаллической решетке вещества. Для этого используют рентгеновское излучение, которое проходит через кристалл и образует характерные дифракционные картины на детекторе. Из анализа этих дифракционных картины можно определить углы и интенсивности дифракционных максимумов, а затем восстановить пространственное распределение атомов в кристалле. После этого можно определить расстояния между атомами и на основе этих данных определить атомный номер элемента, так как каждый элемент имеет свой уникальный атомный радиус.



