Ячейки, в которых скрыта магия истины химической науки, охвачены джунглями загадок, развивающимися со сложностью своей структуры и свойствами. Одним из основных строительных блоков этого изумительного мира являются оксиды - элементарные компоненты, пронизывающие нашу окружающую среду. Они могут создавать разнообразные соединения и обладают уникальными свойствами, которые оказывают влияние на все аспекты нашей жизни. Каждый из них имеет свою собственную структуру и способность взаимодействовать с окружающим миром и другими веществами.
Оксиды являются ключевыми компонентами в химической классификации веществ, их свойства неизменно привлекают внимание ученых. Они представляют собой соединения, образованные соединением кислорода с другими элементами, присутствующими в периодической системе химических элементов. Главное отличие оксидов от других химических соединений заключается в том, что они образуются в результате реакции элемента с кислородом. Все они различаются по своей структуре, химическим свойствам и функциям в разных областях науки и промышленности.
Оксиды играют неоценимую роль в природе и технологии, их разнообразие может вызывать изумление и восторг. Некоторые оксиды выполняют важные функции в организме человека, другие используются в промышленности для производства различных продуктов, а некоторые выполняют роль эффективных катализаторов реакций, происходящих в нашем окружении. Это лишь некоторые из множества разнообразных свойств оксидов, которые делают их такими важными компонентами в современных научных и практических исследованиях.
Роль веществ, обладающих свойствами оксидов, в изучении и практическом применении химии

В химии существует целый класс веществ, которые играют важную роль в промышленной, научной и повседневной деятельности человека. Эти вещества характеризуются наличием оксидации и обладают различными свойствами, которые определяют их специальные функции. Ученые детально изучают, классифицируют и применяют эти оксиды в различных областях химии.
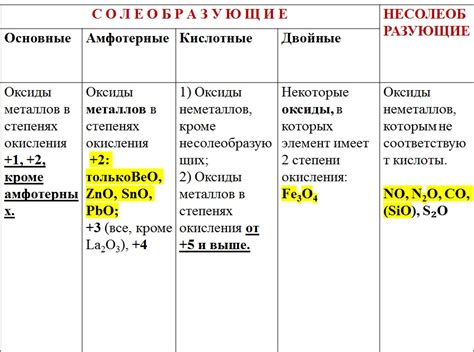
Разнообразие свойств и функций оксидов позволяет связать их с определенными группами элементов и перечислить их в соответствии с их вкладом в химические реакции и процессы:
1. Кислотные оксиды также известны как ангидриды кислот. Их химический состав включает кислотную группу, которая при взаимодействии с водой образует кислоту. Примеры могут включать диоксид серы (SO₂) и трехоксид азота (N₂O₃).
2. Основные оксиды реагируют с водой, образуя основания. Они характеризуются наличием основного типа и все присутствующие вещества могут быть отнесены к этой группе. Некоторые примеры основных оксидов включают оксид кальция (CaO) и оксид натрия (Na₂O).
3. Амфотерные оксиды могут проявлять как основные, так и кислотные свойства в зависимости от условий реакции. Это может включать оксид алюминия (Al₂O₃) и оксид железа (Fe₂O₃).
4. Структура оксидов может быть ионной, молекулярной или координационной, что определяет их реакционную способность и свойства. Данный классификационный подход позволяет более точно описывать свойства и применение оксидов в различных химических процессах.
Таким образом, понимание роли оксидов в химии и их классификация являются важными аспектами для изучения и применения химических реакций и процессов. Каждый тип оксида обладает своими свойствами и функциями, которые определяют его использование в конкретных областях и сферах деятельности.
Примеры и характеристики основных оксидов
Один из примеров основных оксидов - оксид кальция (или известь). Это белый кристаллический порошок, который обладает щелочными свойствами. Он широко используется в строительстве, в производстве цемента и извести. Также оксид кальция применяется в сельском хозяйстве для улучшения почвы и в медицине для лечения желудочных заболеваний.
Еще одним примером является оксид железа (или ржавчина). Этот красноватый порошок образуется при окислении железа воздухом или водой. Он служит важным компонентом в производстве стали и различных металлургических процессах. Оксид железа также применяется в косметической промышленности и в производстве красок и пигментов.
Еще одним примером основного оксида является оксид магния. Этот белый порошок обладает щелочными свойствами и широко используется в медицине, в производстве огнеупорных материалов и в качестве добавки в пищевую промышленность. Оксид магния также применяется в косметике и фармацевтической промышленности.
Рассмотренные примеры основных оксидов и их свойства показывают, что эти соединения являются важными для различных областей промышленности, сельского хозяйства и медицины. Их химические характеристики определяют их широкое применение и значимость в современном мире.
Практическое применение основных оксидов в повседневной жизни

Оксиды играют важную роль в различных сферах нашей жизни, применяясь во множестве практических задач и процессов.
Например, одним из практических применений оксидов является их использование в производстве стекла. Благодаря своей химической структуре и свойствам, различные оксиды, такие как оксид кремния, оксид кальция и оксид бора, используются в процессе плавления и формирования стеклянных изделий. Благодаря этому применению оксиды помогают нам производить окна, посуду, лабораторные стеклянные изделия и многое другое.
Кроме того, основные оксиды нашли применение и в строительной отрасли. Например, оксид алюминия используется в производстве строительных материалов, таких как шлакоблоки, цемент и самоутирающиеся штукатурки. Оксид кальция, или известь, широко применяется в процессе производства строительного раствора или гашения извести, что делает его незаменимым материалом при возведении зданий и сооружений.
Также оксиды находят применение в процессе производства различных красок и пигментов. Оксид цинка, например, используется в производстве белой краски и косметических средств. Медный оксид применяется для создания синего и зеленого пигментов в живописи и керамике.
Как видно из примеров, наличие оксидов важно для реализации множества наших повседневных потребностей, делая их одними из важнейших химических соединений для человечества.
Вопрос-ответ

Какое понятие лежит в основе оксидов в химии?
Основные оксиды - это химические соединения, состоящие из кислорода и металла. Они образуются при соединении кислорода с элементами группы I и II периодической системы, а также с некоторыми элементами группы III. Основные оксиды обладают щелочными свойствами и, растворяясь в воде, образуют щелочные растворы.
Какие примеры можно привести основных оксидов в химии для более наглядного представления?
Одним из примеров основных оксидов является оксид натрия (Na2O). Он образуется при соединении натрия с кислородом. Когда оксид натрия растворяется в воде, образуется щелочной раствор натриевой гидроксидной кислоты. Еще одним примером является оксид кальция (CaO), который образуется при соединении кальция с кислородом. Растворение оксида кальция в воде приводит к образованию щелочи - гидроксида кальция.
Какие свойства имеют основные оксиды в химии 8 класса?
Основные оксиды обладают несколькими характерными свойствами. Во-первых, они растворяются в воде, образуя щелочные растворы. Во-вторых, они обладают выраженными щелочными свойствами, что проявляется в возможности нейтрализации кислот. Основные оксиды также имеют высокую температуру плавления и кипения. Они образуют кристаллические структуры и обладают хорошей электропроводностью в расплавленном состоянии.



